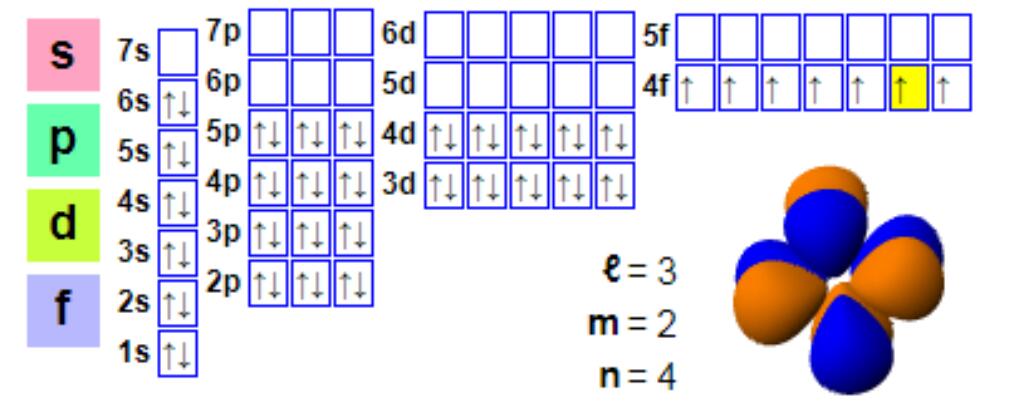
اليوروبيومالرمز هو Eu، والعدد الذري هو 63. اليوروبيوم، كعنصر نموذجي من عناصر اللانثانيد، عادةً ما يكون تكافؤه +3، ولكن تكافؤ الأكسجين +2 شائع أيضًا. هناك عدد قليل من مركبات اليوروبيوم ذات حالة تكافؤ +2. بالمقارنة مع المعادن الثقيلة الأخرى، ليس لليوروبيوم آثار بيولوجية ملحوظة، وهو غير سام نسبيًا. تعتمد معظم تطبيقات اليوروبيوم على التأثير الفسفري لمركبات اليوروبيوم. يُعد اليوروبيوم من أقل العناصر وفرة في الكون؛ إذ يوجد حوالي 5 منها فقط في الكون × 10-8% من المادة.
يوجد اليوروبيوم في المونازيت
اكتشاف اليوروبيوم
تبدأ القصة في نهاية القرن التاسع عشر: في ذلك الوقت، بدأ علماء متميزون بملء الفراغات المتبقية في الجدول الدوري لمندلييف بشكل منهجي من خلال تحليل طيف الانبعاث الذري. واليوم، لا تُعدّ هذه المهمة صعبة، ويمكن لطالب جامعي إنجازها؛ لكن في ذلك الوقت، لم يكن لدى العلماء سوى أجهزة ذات دقة منخفضة وعينات يصعب تنقيتها. لذلك، طوال تاريخ اكتشاف اللانثانيدات، استمر جميع "شبه المكتشفين" في تقديم ادعاءات كاذبة والخلاف فيما بينهم.
في عام ١٨٨٥، اكتشف السير ويليام كروكس أول إشارة، وإن كانت غير واضحة تمامًا، للعنصر ٦٣: إذ لاحظ خطًا طيفيًا أحمر مميزًا (٦٠٩ نانومتر) في عينة من الساماريوم. بين عامي ١٨٩٢ و١٨٩٣، أكد بول إي ميل لوكوك دي بواسبودران، مكتشف الغاليوم والساماريوم والديسبروسيوم، وجود هذا النطاق، واكتشف نطاقًا أخضر آخر (٥٣٥ نانومتر).
في عام ١٨٩٦، قام أوجيني وأناتول ديمار تشاي بفصل أكسيد الساماريوم بصبر، مؤكدًا اكتشاف عنصر أرضي نادر جديد يقع بين الساماريوم والغادولينيوم. نجح في فصل هذا العنصر عام ١٩٠١، معلنًا نهاية رحلة الاكتشاف: "آمل أن أُطلق على هذا العنصر الجديد اسم اليوروبيوم، برمز Eu وكتلته الذرية التي تبلغ حوالي ١٥١".
التوزيع الإلكتروني
التوزيع الإلكتروني:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f7
على الرغم من أن اليوروبيوم عادةً ما يكون ثلاثي التكافؤ، إلا أنه يميل إلى تكوين مركبات ثنائية التكافؤ. تختلف هذه الظاهرة عن تكوين مركبات التكافؤ +3 التي تنتجها معظم اللانثانيدات. لليوروبيوم ثنائي التكافؤ تكوين إلكتروني 4f7، حيث يوفر غلاف f شبه المملوء مزيدًا من الاستقرار، ويتشابه اليوروبيوم (II) والباريوم (II). اليوروبيوم ثنائي التكافؤ عامل اختزال خفيف يتأكسد في الهواء مكونًا مركب اليوروبيوم (III). في ظل الظروف اللاهوائية، وخاصة ظروف التسخين، يكون اليوروبيوم ثنائي التكافؤ مستقرًا بدرجة كافية ويميل إلى الاندماج مع الكالسيوم ومعادن القلوية الترابية الأخرى. تُعد عملية التبادل الأيوني هذه أساس "شذوذ اليوروبيوم السالب"، أي أنه بالمقارنة مع وفرة الكوندريت، فإن العديد من معادن اللانثانيد مثل المونازيت تحتوي على محتوى يوروبيوم منخفض. بالمقارنة مع المونازيت، غالبًا ما يُظهر الباستناسيت شذوذ يوروبيوم سالب أقل، لذا يُعد الباستناسيت أيضًا المصدر الرئيسي لليوروبيوم.
اليوروبيوم معدن رمادي حديدي، درجة انصهاره 822 درجة مئوية، ودرجة غليانه 1597 درجة مئوية، وكثافته 5.2434 غ/سم³. وهو أقل العناصر كثافةً وأكثرها ليونةً وتطايرًا بين العناصر الأرضية النادرة. يُعد اليوروبيوم أكثر المعادن نشاطًا بين العناصر الأرضية النادرة: ففي درجة حرارة الغرفة، يفقد بريقه المعدني فورًا في الهواء ويتأكسد بسرعة ليتحول إلى مسحوق. يتفاعل اليوروبيوم بعنف مع الماء البارد مُنتجًا غاز الهيدروجين. كما يتفاعل مع البورون والكربون والكبريت والفوسفور والهيدروجين والنيتروجين، وغيرها.
استخدامات اليوروبيوم
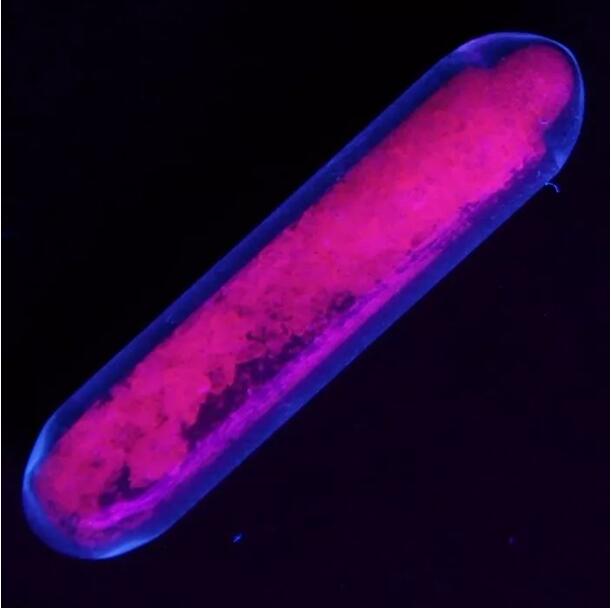
يصدر كبريتات اليوروبيوم فلورسنت أحمر تحت ضوء الأشعة فوق البنفسجية
جورج أوربان، وهو كيميائي شاب بارز، ورث جهاز التحليل الطيفي الخاص بدمار تشاي واكتشف أن عينة أكسيد الإيتريوم (III) المخصبة باليوروبيوم أصدرت ضوءًا أحمر ساطعًا للغاية في عام 1906. وهذه هي بداية الرحلة الطويلة لمواد الفوسفوريوم الأوروبية - التي لم تُستخدم فقط لإصدار الضوء الأحمر، ولكن أيضًا الضوء الأزرق، لأن طيف انبعاث Eu2+ يقع ضمن هذا النطاق.
مادة فوسفورية مكونة من مُشعّات Eu3+ الحمراء، وTb3+ الخضراء، وEu2+ الزرقاء، أو مزيج منها، قادرة على تحويل الضوء فوق البنفسجي إلى ضوء مرئي. وتلعب هذه المواد دورًا هامًا في العديد من الأجهزة حول العالم، مثل شاشات تكثيف الأشعة السينية، وأنابيب أشعة الكاثود، وشاشات البلازما، بالإضافة إلى مصابيح الفلورسنت الموفرة للطاقة الحديثة، والثنائيات الباعثة للضوء.
يمكن أيضًا تحسيس التأثير الفلوري لليوروبيوم الثلاثي التكافؤ بواسطة جزيئات عطرية عضوية، ويمكن تطبيق مثل هذه المجمعات في مواقف مختلفة تتطلب حساسية عالية، مثل أحبار مكافحة التزييف والرموز الشريطية.
منذ ثمانينيات القرن الماضي، يلعب اليوروبيوم دورًا رائدًا في التحليلات الصيدلانية الحيوية عالية الحساسية باستخدام طريقة الفلورسنت البارد المُحلل زمنيًا. وقد أصبح هذا التحليل روتينيًا في معظم المستشفيات والمختبرات الطبية. وفي أبحاث علوم الحياة، بما في ذلك التصوير البيولوجي، تنتشر المجسات البيولوجية الفلورية المصنوعة من اليوروبيوم وعناصر اللانثانيد الأخرى على نطاق واسع. ولحسن الحظ، يكفي كيلوغرام واحد من اليوروبيوم لدعم ما يقرب من مليار تحليل - فبعد أن فرضت الحكومة الصينية مؤخرًا قيودًا على صادرات العناصر الأرضية النادرة، لم تعد الدول الصناعية، التي أصابها الذعر بسبب نقص مخزون العناصر الأرضية النادرة، مضطرة للقلق بشأن تهديدات مماثلة لهذه التطبيقات.
يُستخدم أكسيد اليوروبيوم كفوسفور انبعاث مُحفَّز في أنظمة التشخيص الطبي بالأشعة السينية الجديدة. كما يُمكن استخدامه في تصنيع العدسات الملونة والمرشحات البصرية الإلكترونية، وفي أجهزة تخزين الفقاعات المغناطيسية، وفي مواد التحكم، ومواد التدريع، والمواد الهيكلية للمفاعلات الذرية. ولأن ذراته قادرة على امتصاص نيوترونات أكثر من أي عنصر آخر، فإنه يُستخدم عادةً كمادة لامتصاص النيوترونات في المفاعلات الذرية.
في عالمنا المتسارع النمو، قد يكون لاستخدام اليوروبيوم المُكتشف حديثًا آثارٌ عميقة على الزراعة. فقد وجد العلماء أن البلاستيك المُضاف إليه اليوروبيوم ثنائي التكافؤ والنحاس أحادي التكافؤ قادرٌ على تحويل الأشعة فوق البنفسجية من ضوء الشمس بكفاءة إلى ضوء مرئي. هذه العملية خضراء تمامًا (وهي الألوان المُكمّلة للأحمر). إن استخدام هذا النوع من البلاستيك لبناء دفيئة يُمكّن النباتات من امتصاص المزيد من الضوء المرئي، مما يزيد من إنتاجية المحاصيل بنسبة تقارب 10%.
يمكن أيضًا استخدام اليوروبيوم في رقائق الذاكرة الكمومية، التي يمكنها تخزين المعلومات بشكل موثوق لعدة أيام متواصلة. وهذا يُمكّن من تخزين البيانات الكمومية الحساسة في جهاز يُشبه القرص الصلب، وشحنها عبر البلاد.
وقت النشر: ٢٧ يونيو ٢٠٢٣