السيريوم هو بلا منازع "الأخ الأكبر" في عائلة العناصر الأرضية النادرة. أولًا، تبلغ الوفرة الإجمالية للعناصر الأرضية النادرة في القشرة الأرضية 238 جزءًا في المليون، منها 68 جزءًا في المليون للسيريوم، وهو ما يمثل 28% من إجمالي تركيب العناصر الأرضية النادرة، ويحتل المرتبة الأولى. ثانيًا، يُعد السيريوم ثاني عنصر أرضي نادر يُكتشف بعد تسع سنوات من اكتشاف الإيتريوم (1794). استخداماته واسعة جدًا، و"السيريوم" لا يُقهر.
اكتشاف عنصر السيريوم

كارل أوير فون ويلسباخ
اكتُشف السيريوم وأطلق عليه هذا الاسم عام ١٨٠٣ من قِبل الألماني كلوبرز، والكيميائي السويدي يونس جاكوب بيرزيليوس، وعالم المعادن السويدي فيلهلم هيسينجر. يُسمى سيريا، ويُسمى خامه سيريت، تخليدًا لذكرى سيريس، الكويكب الذي اكتُشف عام ١٨٠١. في الواقع، هذا النوع من سيليكات السيريوم عبارة عن ملح مُهَيَّأ يحتوي على ٦٦٪ إلى ٧٠٪ من السيريوم، بينما الباقي عبارة عن مركبات من الكالسيوم والحديد و...الإيتريوم.
كان أول استخدام للسيريوم في مدفأة غازية اخترعها الكيميائي النمساوي كارل أوير فون ويلسباخ. في عام ١٨٨٥، حاول تحضير خليط من المغنيسيوم واللانثانوم وأكسيد الإيتريوم، لكن هذه الخلطات أصدرت ضوءًا أخضر دون جدوى.
في عام ١٨٩١، وجد أن أكسيد الثوريوم النقي يُنتج ضوءًا أفضل، وإن كان أزرق اللون، ويُخلط بأكسيد السيريوم الرباعي لإنتاج ضوء أبيض ساطع. بالإضافة إلى ذلك، يُمكن استخدام أكسيد السيريوم الرباعي كمحفز لاحتراق أكسيد الثوريوم.
معدن السيريوم

السيريوم معدن أبيض فضيّ ناعم ومرن، ذو خصائص فعّالة. عند تعرضه للهواء، يتأكسد مكونًا طبقة أكسيد متقشرة تشبه الصدأ. عند تسخينه، يحترق ويتفاعل بسرعة مع الماء. تتآكل عينة من معدن السيريوم بحجم سنتيمتر واحد تمامًا في غضون عام تقريبًا. تجنب ملامسته للهواء، أو المؤكسدات القوية، أو الأحماض القوية، أو الهالوجينات.
★ يوجد السيريوم بشكل رئيسي في المونازيت والباستنازيت، وكذلك في نواتج انشطار اليورانيوم والثوريوم والبلوتونيوم. ولأنه ضار بالبيئة، يجب إيلاء اهتمام خاص لتلوث المسطحات المائية.
★ السيريوم هو العنصر السادس والعشرون من حيث الوفرة، إذ يُشكل 68 جزءًا في المليون من قشرة الأرض، محتلًا المرتبة الثانية بعد النحاس (68 جزءًا في المليون). السيريوم أكثر وفرة من المعادن العادية مثل الرصاص (13 جزءًا في المليون) والقصدير (2.1 جزء في المليون).
التوزيع الإلكتروني للسيريوم
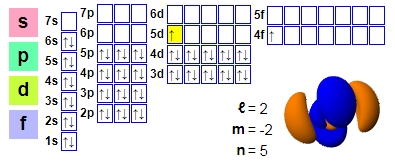
الترتيبات الإلكترونية:
1س2 2س2 2ب6 3س2 3ب6 4س2 3د10 4ب6 5س2 4د10 5ب66س2 4ف1 5د1
★ يقع السيريوم بعد اللانثانوم، ويحتوي على إلكترونات 4f تبدأ من السيريوم، مما يُسهّل مشاركته في التفاعلات الكيميائية. مع ذلك، فإن المدار 5d للسيريوم مشغول، وهذا التأثير ليس قويًا بما يكفي في السيريوم.
★ معظم اللانثانيدات لا تستخدم سوى ثلاثة إلكترونات كإلكترونات تكافؤ، باستثناء السيريوم ذي التركيب الإلكتروني المتغير. طاقة إلكترونات 4f تساوي تقريبًا طاقة إلكترونات 5d و6s الخارجية غير الموضعية في الحالة المعدنية، ولا يتطلب تغيير التوزيع النسبي لمستويات الطاقة الإلكترونية هذه سوى كمية ضئيلة من الطاقة، مما ينتج عنه تكافؤ مزدوج لـ +3 و+4. الحالة الطبيعية هي +3 تكافؤ، مما يُظهر +4 تكافؤ في الماء اللاهوائي.
تطبيق السيريوم

★ يمكن استخدامه كمضاف للسبائك ولإنتاج أملاح السيريوم وما إلى ذلك.
★ يمكن استخدامه كمادة مضافة للزجاج لامتصاص الأشعة فوق البنفسجية والأشعة تحت الحمراء، ويُستخدم على نطاق واسع في زجاج السيارات.
★ يمكن استخدامه كمواد ممتازة لحماية البيئة، والأكثر تمثيلاً حاليًا هو محفز تنقية عوادم السيارات، والذي يمنع بشكل فعال كمية كبيرة من غاز عوادم السيارات من التفريغ في الهواء.
★ ضوءالعناصر الأرضية النادرةمنظمات نمو النبات المكونة بشكل أساسي من السيريوم يمكنها تحسين جودة المحاصيل وزيادة الغلة وتعزيز مقاومة المحاصيل للإجهاد.
★ يمكن أن يحل كبريتيد السيريوم محل المعادن مثل الرصاص والكادميوم الضارة بالبيئة والبشر في الأصباغ، ويمكنه تلوين البلاستيك، ويمكن استخدامه أيضًا في صناعات الطلاء والحبر.
★أكسيد السيريوم (IV)يمكن استخدامه كمركب تلميع، على سبيل المثال، في التلميع الكيميائي الميكانيكي (CMP).
★ يمكن استخدام السيريوم أيضًا كمواد لتخزين الهيدروجين، ومواد حرارية كهربائية، وأقطاب تنجستن السيريوم، ومكثفات سيراميكية، وسيراميك كهرضغطي، ومواد كاشطة من كربيد السيليكون السيريوم، ومواد خام لخلايا الوقود، ومحفزات البنزين، ومواد مغناطيسية دائمة، ومواد طبية، وسبائك فولاذية مختلفة، ومعادن غير حديدية.
وقت النشر: 03-07-2023