السيريوم هو "الأخ الأكبر" بلا منازع في عائلة كبيرة من العناصر الأرضية النادرة.أولاً، يبلغ إجمالي وفرة العناصر الأرضية النادرة في القشرة الأرضية 238 جزءًا في المليون، مع وجود السيريوم عند 68 جزءًا في المليون، وهو ما يمثل 28% من إجمالي تكوين العناصر الأرضية النادرة ويحتل المرتبة الأولى؛ثانيًا، السيريوم هو ثاني عنصر أرضي نادر يتم اكتشافه بعد تسع سنوات من اكتشاف الإيتريوم (1794).تطبيقه واسع النطاق للغاية، ولا يمكن إيقاف "السيريوم".
اكتشاف عنصر السيريوم

كارل أوير فون ويلسباخ
تم اكتشاف السيريوم وتسميته في عام 1803 من قبل الألماني كلوبرز، والكيميائي السويدي يونس جاكوب بيرسيليوس، وعالم المعادن السويدي فيلهلم هيسينجر.ويسمى سيريا، ويسمى خامه سيريت، تخليدا لذكرى سيريس، وهو كويكب اكتشف عام 1801. وفي الواقع، هذا النوع من سيليكات السيريوم عبارة عن ملح مائي يحتوي على 66% إلى 70% من السيريوم، أما الباقي فهو عبارة عن مركبات من الكالسيوم. والحديد والإيتريوم.
أول استخدام للسيريوم كان في مدفأة الغاز التي اخترعها الكيميائي النمساوي كارل أوير فون ويلسباخ.وفي عام 1885، حاول خلط خليط من المغنيسيوم واللانثانوم وأكسيد الإيتريوم، لكن هذه الخلائط أصدرت ضوءًا أخضر دون نجاح.
وفي عام 1891، وجد أن أكسيد الثوريوم النقي ينتج ضوءًا أفضل، على الرغم من أنه كان أزرق اللون، ويتم مزجه مع أكسيد السيريوم (IV) لإنتاج ضوء أبيض ساطع.بالإضافة إلى ذلك، يمكن أيضًا استخدام أكسيد السيريوم (IV) كمحفز لاحتراق أكسيد الثوريوم.
معدن السيريوم

★ السيريوم هو معدن أبيض فضي ناعم ومرن وله خصائص نشطة.عند تعرضه للهواء، سوف يتأكسد، ويشكل طبقة أكسيد تشبه الصدأ.عند تسخينه يحترق ويتفاعل بسرعة مع الماء.تتآكل عينة من معدن السيريوم بحجم سنتيمتر كامل خلال عام تقريبًا.تجنب ملامسة الهواء والمواد المؤكسدة القوية والأحماض القوية والهالوجينات.
★ يتواجد السيريوم بشكل رئيسي في المونازيت والباستناسيت، وكذلك في منتجات انشطار اليورانيوم والثوريوم والبلوتونيوم.ضارة بالبيئة، وينبغي إيلاء اهتمام خاص لتلوث المسطحات المائية.
★ السيريوم هو العنصر السادس والعشرون الأكثر وفرة، وهو ما يمثل 68 جزء في المليون من قشرة الأرض، في المرتبة الثانية بعد النحاس (68 جزء في المليون).السيريوم أكثر وفرة من المعادن العادية مثل الرصاص (13 جزء في المليون) والقصدير (2.1 جزء في المليون).
تكوين إلكترون السيريوم
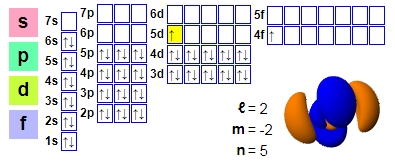
الترتيبات الإلكترونية:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f1 5d1
★ يقع السيريوم بعد اللانثانوم ويحتوي على 4f إلكترونات بدءًا من السيريوم، مما يسهل المشاركة في التفاعلات الكيميائية.ومع ذلك، فإن المدار 5d للسيريوم مشغول، وهذا التأثير ليس قويا بما فيه الكفاية في السيريوم.
★ يمكن لمعظم اللانثانيدات استخدام ثلاثة إلكترونات فقط كإلكترون التكافؤ، باستثناء السيريوم، الذي له بنية إلكترونية متغيرة.إن طاقة إلكترونات 4f هي تقريبًا نفس طاقة الإلكترونات الخارجية 5d و6s غير المتمركزة في الحالة المعدنية، ولا يلزم سوى كمية صغيرة من الطاقة لتغيير الوظيفة النسبية لمستويات الطاقة الإلكترونية هذه، مما يؤدي إلى التكافؤ المزدوج لـ +3 و+4.الحالة الطبيعية هي +3 التكافؤ، وتظهر +4 التكافؤ في الماء اللاهوائي.
تطبيق السيريوم

★ يمكن استخدامه كمادة مضافة للسبائك ولإنتاج أملاح السيريوم، الخ.
★ يمكن استخدامه كمادة مضافة للزجاج لامتصاص الأشعة فوق البنفسجية والأشعة تحت الحمراء، ويستخدم على نطاق واسع في زجاج السيارات.
★ يمكن استخدامه كمادة ممتازة لحماية البيئة، والأكثر تمثيلاً حاليًا هو محفز تنقية عوادم السيارات، والذي يمنع بشكل فعال تفريغ كمية كبيرة من غاز عادم السيارات في الهواء.
★ الضوءالعناصر الأرضية النادرةيتكون بشكل أساسي من السيريوم حيث يمكن لمنظمات نمو النبات تحسين جودة المحاصيل وزيادة الغلة وتعزيز مقاومة إجهاد المحاصيل.
★ يمكن لكبريتيد السيريوم أن يحل محل المعادن مثل الرصاص والكادميوم الضارة بالبيئة والإنسان في الأصباغ، ويمكن تلوين البلاستيك، ويمكن استخدامه أيضًا في صناعات الطلاء والحبر.
★أكسيد السيريوم (الرابع).يمكن استخدامه كمركب تلميع، على سبيل المثال، في التلميع الكيميائي والميكانيكي (CMP).
★ يمكن أيضًا استخدام السيريوم كمواد لتخزين الهيدروجين، والمواد الكهروحرارية، وأقطاب التنغستن السيريوم، ومكثف السيراميك، والسيراميك الكهرضغطي، والمواد الكاشطة من كربيد السيليكون السيريوم، والمواد الخام لخلايا الوقود، ومحفزات البنزين، والمواد المغناطيسية الدائمة، والمواد الطبية، ومختلف سبائك الفولاذ وغير المعادن الفلزية.
وقت النشر: 03 يوليو 2023